鉛蓄電池の充放電(1)放電のしくみ
放電と充電=電子の移動
蓄電池の放電や充電は、いわば、金属(極板)の間で行われる電子のキャッチボールです。
金属から電子を移動(充放電)させるため、イオンになりやすい金属となりにくい金属を電解液に浸します。
イオンになりやすい金属は負極(充電時は陰極)、なりにくい金属が正極(充電時は陽極)になります。
負極で起こる化学反応(酸化)と、正極で起こる化学反応(還元)によって、電子は負極から正極に移動し、電気が発生(放電)します。
※イオンとは・・電子を得たり失う事により電荷を帯びた原子や分子の事。
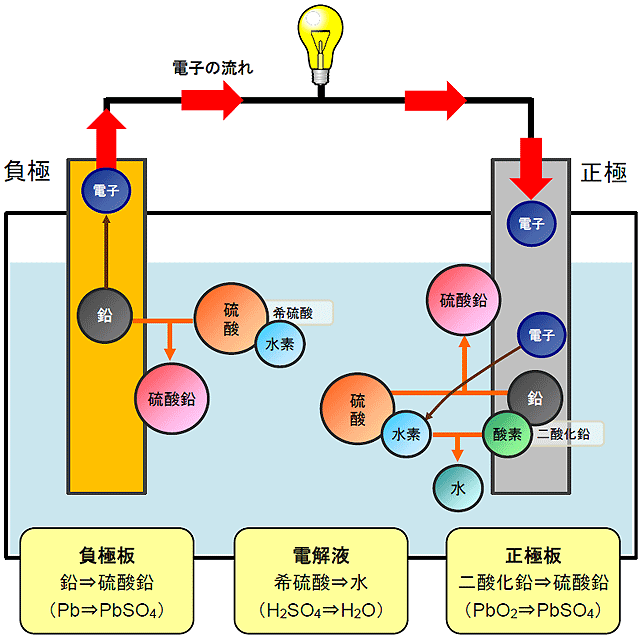
鉛蓄電池の放電のしくみ
鉛蓄電池の負極板にはイオンになりやすい鉛を、正極にはイオンになりにくい二酸化鉛(酸素+鉛)を使用しています。これらの極板は、酸化還元を促す電解液である希硫酸(硫酸+水)に浸されています。
1. 負極での化学反応
負極板(鉛)を希硫酸につけると、鉛が硫酸に反応し「酸化」が始まります。鉛は、硫酸とくっつきやすい性質があり、自ら持っている電子を手放し、代わりに硫酸とくっつこうとします。鉛と硫酸がくっつくと「硫酸鉛」(サルフェーション)という固体になり、負極板表面に付着していきます。
2. 電解液内の様子
このとき、電解液内では、硫酸が鉛と引き合うため硫酸濃度は下がっていき、水素が過剰な状態になっています。
3. 正極での化学反応
負極で鉛に手放された電子が電線を伝って正極板に移動します。この時電気が発生(放電)します。正極板の二酸化鉛(酸素+鉛)の鉛は、電解液中の硫酸と反応して硫酸鉛になりますが、負極板と比べてイオンになりにくい金属ですので、その反応はかなり小さいです。
4. 電解液内の様子
電子が正極板に移動した事で、電解液中で過剰になっていた水素が正極板にひきつけられて電子を受け取り、水素原子になります。正極板で硫酸鉛が生成されたことによって手放されていた酸素が、電解液中の水素とくっつき水を生成(還元)します。
※電子の移動がなければ電気は発生しないので、負極と正極を繋ぐ電線が無ければ、以下の化学反応は基本的には起こりません。
バッテリー再生システムに関する資料は、以下よりご請求ください。
資料請求フォームYou can download the document of 'The Battery Regeneration' in English.
Document Request Formバッテリーの劣化寿命診断サービスやバッテリー再生に関するご依頼やお問合せは、下記よりご連絡ください。
お問合せフォーム