アルカリ蓄電池の充放電(1)放電のしくみ
放電と充電=電子の移動
蓄電池の放電や充電は、いわば、金属(極板)の間で行われる電子のキャッチボールです。
金属から電子を移動(充放電)させるため、イオンになりやすい金属となりにくい金属を電解液に浸します。
イオンになりやすい金属は負極(充電時は陰極)、なりにくい金属が正極(充電時は陽極)になります。
負極で起こる化学反応(酸化)と、正極で起こる化学反応(還元)によって、電子は負極から正極に移動し、電気が発生(放電)します。
※イオンとは・・電子を得たり失う事により電荷を帯びた原子や分子の事。
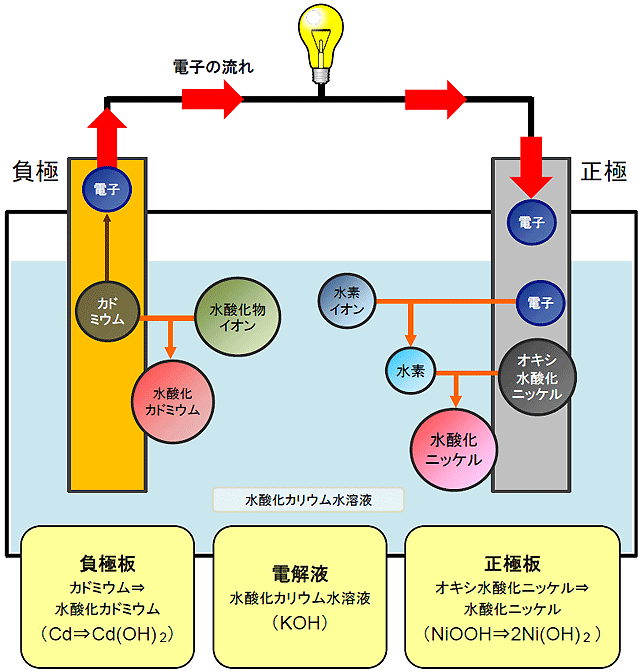
アルカリ蓄電池(ニッケルカドミウム蓄電池)の放電のしくみ
アルカリ蓄電池には、「ニッケル水素蓄電池」や「鉄カドミウム蓄電池」など、極板に使用している素材により名前が異なります。
ここでは、非常用蓄電池やエンジン始動用など、産業用バッテリーとして多く使われている「ニッケルカドミウム蓄電池」を例にして説明します。
ニッケルカドミウム蓄電池の負極板にはイオンになりやすい金属カドミウムを、正極にはイオンになりにくいオキシ水酸化ニッケルを使用しています。
これらの極板は、酸化還元を促す電解液である水酸化カリウム水溶液に浸されています。
1. 負極での化学反応
負極板(カドミウム)を電解液に(水酸化カリウム)に浸すと、カドミウムが電解液中に溶け出し、電解液中の水酸化物イオンと結合して水酸化カドミウムとなります。
このとき、負極にはカドミウムが溶け出した際に手放された電子が蓄積されます。
2. 電解液内の様子
電解液内では、水酸化物イオンが負極のカドミウムと結合したため、水素イオンが残ります。
3. 正極での化学反応
負極板に蓄積された電子が電線を伝って正極板に移動します。この時電気が発生(放電)します。電子が正極板に移動した事で、電解液中の水素イオンが正極板にひきつけられて電子を受け取り、水素原子になります。
この水素原子は、正極板であるオキシ水酸化ニッケルと結合して水酸化ニッケルになります。
◎アルカリ蓄電池(ニッケルカドミウム蓄電池)の電解液の比重について
鉛蓄電池の充放電では電解液比重が変化しましたが、ニッケルカドミウム蓄電池の場合、電解液である水酸化カリウム水溶液は電気を伝導する役割を担うだけなので、比重の変化はありません。
バッテリー再生システムに関する資料は、以下よりご請求ください。
資料請求フォームYou can download the document of 'The Battery Regeneration' in English.
Document Request Formバッテリーの劣化寿命診断サービスやバッテリー再生に関するご依頼やお問合せは、下記よりご連絡ください。
お問合せフォーム