アルカリ蓄電池の充放電(2)充電のしくみ
放電と充電=電子の移動
蓄電池の放電や充電は、いわば、金属(極板)の間で行われる電子のキャッチボールです。
金属から電子を移動(充放電)させるため、イオンになりやすい金属となりにくい金属を電解液に浸します。
イオンになりやすい金属は陰極(放電時は負極)、なりにくい金属が陽極(放電時は正極)になります。
負極で起こる化学反応(酸化)と、正極で起こる化学反応(還元)によって、電子は負極から正極に移動し、電気が発生(放電)します。
(詳しくは「アルカリ蓄電池の充放電(1)放電のしくみ」をご覧ください。)
※イオンとは・・電子を得たり失う事により電荷を帯びた原子や分子の事。
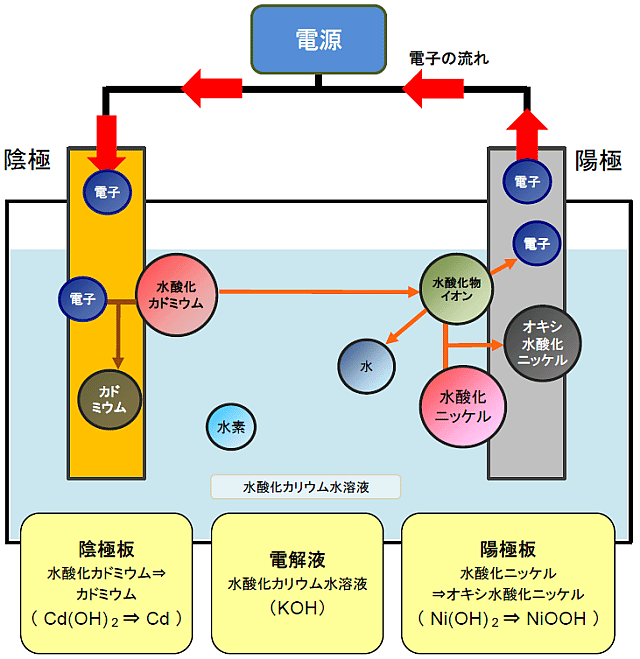
アルカリ蓄電池(ニッケルカドミウム蓄電池)の充電のしくみ
アルカリ蓄電池には、「ニッケル水素蓄電池」や「鉄カドミウム蓄電池」など、極板に使用している素材により名前が異なります。
ここでは、非常用蓄電池やエンジン始動用など、産業用バッテリーとして多く使われている「ニッケルカドミウム蓄電池」を例にして説明します。
ニッケルカドミウム蓄電池の陰極板にはイオンになりやすい金属カドミウムを、陽極にはイオンになりにくいオキシ水酸化ニッケルを使用しています。
これらの極板は、酸化還元を促す電解液である水酸化カリウム水溶液に浸されています。
1. 陰極での化学反応
電源から電子が供給され、水酸化カドミウムは電子と引き合い、水酸化物イオンを電解液中に手放し、金属カドミウムになります。
2. 陽極での化学反応
陰極で手放された水酸化物イオンは陽極に引き付けられ、陽極板に接触した時、電子を陽極板に渡します。
電子を失った水酸化物イオンは電気的に中性の水酸化物に変化します。
この水酸化物は水酸化ニッケルと反応し、オキシ水酸化ニッケルと水になります。
バッテリー再生システムに関する資料は、以下よりご請求ください。
資料請求フォームYou can download the document of 'The Battery Regeneration' in English.
Document Request Formバッテリーの劣化寿命診断サービスやバッテリー再生に関するご依頼やお問合せは、下記よりご連絡ください。
お問合せフォーム