鉛蓄電池の充放電(2)充電のしくみ
放電と充電=電子の移動
蓄電池の放電や充電は、いわば、金属(極板)の間で行われる電子のキャッチボールです。
金属から電子を移動(充放電)させるため、イオンになりやすい金属となりにくい金属を電解液に浸します。
イオンになりやすい金属は陰極(放電時は負極)、なりにくい金属が陽極(放電時は正極)になります。
負極で起こる化学反応(酸化)と、正極で起こる化学反応(還元)によって電子は負極から正極に移動し、電気が発生(放電)します。
(詳しくは「鉛蓄電池の充放電(1)放電のしくみ」をご覧ください。)
※イオンとは・・電子を得たり失う事により電荷を帯びた原子や分子の事。
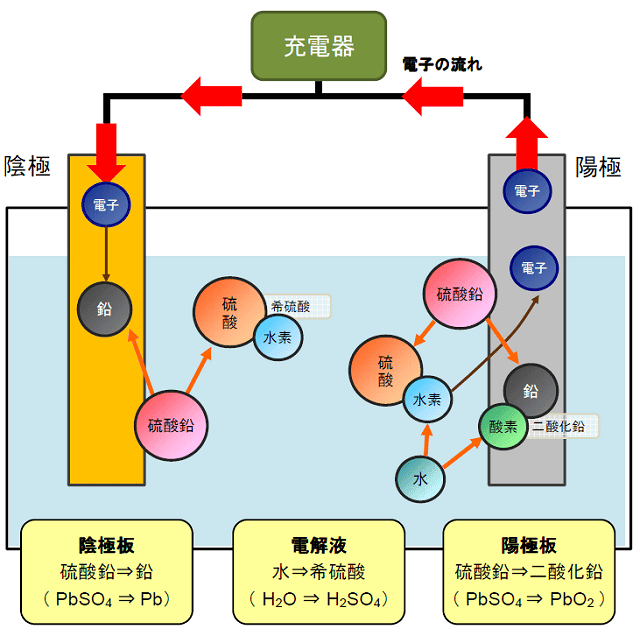
鉛蓄電池の充電のしくみ
鉛蓄電池の陰極板にはイオンになりやすい鉛を、陽極にはイオンになりにくい二酸化鉛(酸素+鉛)を使用しています。これらの極板は、酸化還元を促す電解液である希硫酸(硫酸+水)に浸されています。
放電した鉛蓄電池を充電するには、陰極から陽極へ電子を移動させます。充電を行う場合は、充電器の正極と負極を、それぞれ鉛蓄電池の陽極と陰極に接続してから電流を流します。
1. 陽極での化学反応
充電によって、陽極板に付着した硫酸鉛は、電解液中の水と反応して酸化鉛に変化し、硫酸と水素を電解液中に放出します。このとき、水素から電子が引き剥がされ、陽極から陰極に向かって電子が移動します。
2. 陰極での化学反応
陰極板の硫酸鉛は、陽極から流れ込んだ電子を取り込んで鉛に変化し、硫酸を電解液中に放出します。
3. 電解液内の様子
両極板から放出された硫酸と、陽極板から放出された水素が結合して希硫酸になります。
※電解液量の減少について
充電が進み完全充電状態に近くなってくると、電解液中の水の電気分解により酸素ガスと水素ガスが発生し電解液量が減少します。
電解液量がバッテリーの容器に示されている「最低液面線」よりも下がっている場合は、精製水を補給する必要があります。
補水する目安量については、「バッテリー再生事業 メンテナンスページ」をご覧ください。
バッテリー再生システムに関する資料は、以下よりご請求ください。
資料請求フォームYou can download the document of 'The Battery Regeneration' in English.
Document Request Formバッテリーの劣化寿命診断サービスやバッテリー再生に関するご依頼やお問合せは、下記よりご連絡ください。
お問合せフォーム